前段时间有家做过滤器材的公司(后文简称A公司)找到我们,说是可以给我们提供核酸纯化柱。虽然Simgen的核酸纯化柱都是自产的,但是出于好奇,我们还是要了一些试用装,测试它的核酸吸附效率以及稳定性。现在我们把测试方法分享给大家,作为核酸纯化柱选择的一个依据。
(一)实验目的
对比测试Simgen核酸纯化柱和A公司核酸纯化柱的性能。
(二)实验材料与设备:
1. 新鲜培养的质粒菌
2. 快速质粒DNA小量试剂盒(Simgen Cat.No.1005050)、A公司提供的质粒DNA纯化柱
3. 台式离心机(eppendorf Centrifuge 5415 D)
4. 旋涡振荡器(越新仪器,XH BH-C)
5. 超微量分光光度计(Simgen Cat.No.Sim-100)
6. 电泳仪(北京六一仪器厂,DYY-6C型 )
7. 电热恒温培养箱(上海精宏实验设备有限公司,DNP-9082)
(三)实验内容:
1. 12000 rpm离心30秒收集5管3 ml过夜培养的细菌,弃尽培养基。加入250 μl已加入RNase A 的Buffer I,充分悬浮沉淀的细菌。
2. 加入250 μl Buffer II,温和并充分地翻转离心管4-6次。
3. 加入350 μl Buffer N8,温和并充分地翻转离心管直至溶液中残留的蓝色沉淀全部消失,转变为淡黄色沉淀。
4. 13200 rpm离心2分钟。
5. 将所有上清液倒入50 ml离心管中,混合均匀,各取2个Simgen公司和A公司的核酸纯化柱置于2 ml离心管中,吸取800 μl混匀的上清液加入到各个核酸纯化柱中,盖上管盖,12000 rpm离心30秒。
6. 弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,在核酸纯化柱中加入800 μl Buffer W2,盖上管盖,12000 rpm离心30秒。
7. 弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,最高速13200 rpm离心1分钟。
8. 弃2 ml离心管,将核酸纯化柱置于一个洁净的1.5 ml离心管中,在纯化柱的膜中央加入60 μl Buffer E,盖上管盖,室温静置1分钟,12000 rpm离心30秒。
9. 在超微量分光光度计上测量洗脱的质粒DNA的浓度并进行琼脂糖凝胶电泳检测。
10. 各取10个Simgen公司和A公司的核酸纯化柱,在50℃恒温箱中放置7天,7天后各取出2个核酸纯化柱,再加上2个Simgen公司同一批的未放入恒温箱的纯化柱,按步骤1-9再测试一遍。
(四)实验结果:
1. 在超微量分光光度计上用Buffer E调零,测量洗脱的质粒DNA,结果如下:
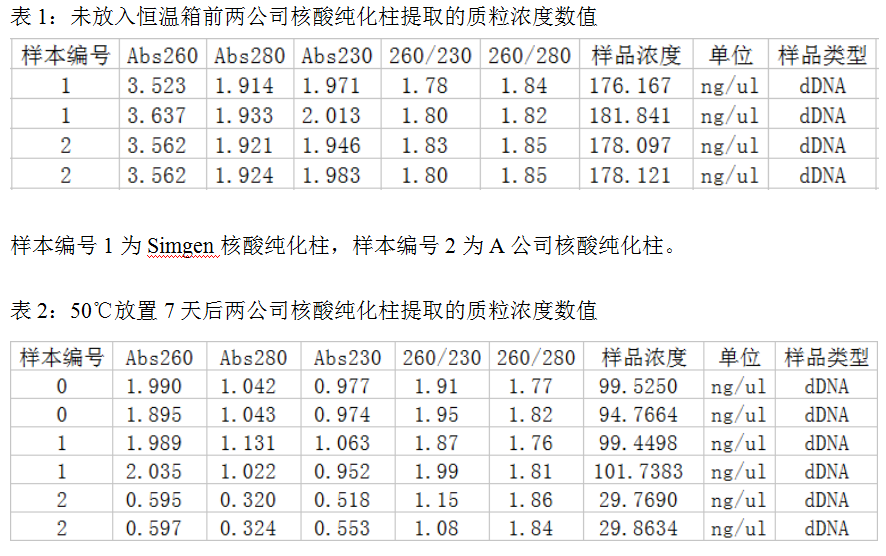
样本编号0为常温放置7天的Simgen核酸纯化柱,样本编号1为50℃放置7天的Simgen核酸纯化柱,样本编号2为50℃放置7天的A公司核酸纯化柱。
2. 在1%的琼脂糖凝胶上,加入5 μl提取到的质粒DNA,电泳20分钟,结果如下: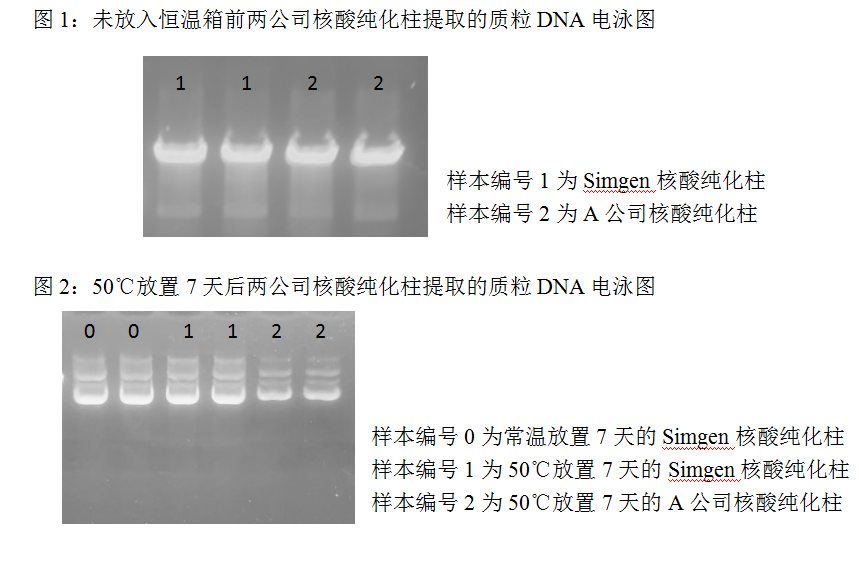
(五)实验讨论与分析:
1. 结合表1和图1分析可知,未经恒温箱放置前,两公司的核酸纯化柱对质粒DNA的吸附效率无明显差异。
2. 结合表2和图2分析可知,Simgen核酸纯化柱在50℃放置7天后核酸吸附效果未受影响,与室温放置的对照组吸附效率无明显差异,而A公司的核酸纯化柱在50℃放置7天后核酸吸附效果明显变差,吸附效率只有原来的30%。
3. 作为柱式核酸纯化试剂盒中的核酸纯化柱,其重要性往往被忽略,甚至是国际巨头Qiagen公司也栽过跟头,曾经要求用户将柱子放到2~8℃储存,以免影响其回收效率。所以测试纯化柱稳定性的方法也很简单,只要将纯化柱在高于常温的条件下放置一段时间,就能辨别出柱子的稳定性差异。国内的T**ngen、O**ga等厂家的一些试剂盒要求用户在使用前用平衡液洗涤纯化柱,其本质就是纯化柱稳定性有缺陷所导致的。所以用户在大量选购纯化柱时务必要做一下纯化柱的稳定性测试,如果不巧是选用了来源不明的核酸纯化柱(特别是没有核酸纯化技术累积的公司),为了保险起见,最好是放到2~8℃储存。

·8分钟内即可完成质粒DNA的制备,无须酚氯仿抽提·革命性的创新发明Buffer N8,2分钟内获得无漂浮沉淀的上清液·核酸纯化柱无须平衡液处理即可使用·特殊的添加中和指示剂设计,使初次使用者也可以获得最佳的质粒抽提效果 查看产品

·国产膜及塑料材质组装,无需平衡液处理,可直接使用·2-10 kb 质粒 DNA 饱和结合能力大于 25 μg·极其稳定的 DNA 吸附性能,常温(0-30℃)放置两年无使用性能降低现象·可配合各个不同厂家的核酸纯化试剂使用·可用于离心机或负压装置上的操作 查看产品

·样品用量少,无需稀释,无需比色皿·紫外-可见光全波长扫描(200~850nm)·无需预热,随开随检,速度快,直接显示浓度值·样品的浓度范围是常规紫外-可见分光光度计的50倍·数据统计软件简单容易掌握 查看产品