什么是OD260 /OD 230 ?
核酸所含嘌呤和嘧啶分子具有共轭双键,在260nm波长处有最大吸收峰。盐离子等其他污染物在OD230处有最大吸收峰,所以OD260 / OD 230用来评估样品中是否存在一些污染物,如碳水化合物,多肽,苯酚等,较纯净的核酸OD260 / OD 230 的比值应大于2.0。
如何提高OD260 /OD 230 ?请先看小新做的几个实验。
以下实验均是使用Simgen全血DNA小量试剂盒(Cat.No.3001050)从400 μl全血中分离纯化的基因组DNA,在微量紫外分光光度计上测定的核酸数据。
第一轮,按照说明书常规步骤操作,加完洗涤液Buffer WA后立即离心,测定结果如下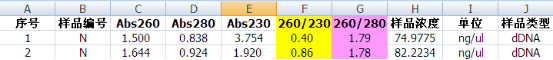
测定结果中OD260 / OD230比值太低,是不是表明里面的盐分等污染物残留太多了?我们之所以控制OD260 / OD230比值,主要是为了下游实验不受影响,因为有些污染物会对后续的一些反应实验产生抑制作用。为了知道本次提取的DNA对PCR实验有没有影响,小新取了18μl作模板(40μl体系)进行全血1.3 kb PCR扩增。结果显示,PCR扩增并没有任何抑制现象。
下面是PCR产物电泳图:

实际上单纯从OD260 / OD 230的数值上来判断盐分是否残留过高并不准确:即使残留相同浓度的盐分在核酸溶液中,某些盐分在230nm处有强吸收峰的,也会严重降低OD260 / OD 230的比值。但这并不等于核酸就不能使用了,第一轮实验获得的DNA用作PCR的模板并没有出现抑制现象就证明了这一点(本次PCR体系40 μl,加入了接近一半反应体系(18 μl)的模板)。当然,也正是因为这种在230nm有强吸收峰的杂质的存在,为我们提供了减少盐分残留的线索。
虽然PCR实验没有因为OD260 / OD230比值低受到影响,但是如果有办法提高这个比值岂不是更好。之后,小新踏上了提高OD260 / OD230比值之旅。
第二轮实验,小新在原有步骤上做了一点改变:在加完洗涤液Buffer WA后盖上核酸纯化柱的盖子静置了5min再离心,最后的实验数据OD260/OD230平均值就有了明显的提高。看下图,

说明浸泡洗涤法是有用的,但是还是离2.0以上相差甚远。
第三轮实验,小新又重做一遍,其他条件都不变,在加完Buffer WA后开盖静置5min,最终测定的实验数据OD260/OD230的值均已超过1.5,有一组数据已经到达2.0以上。

同样都是静置,这两轮实验最终造成不同的结果,这是什么原因呢?第二轮实验在加洗涤液Buffer WA后室温静置了5 min, 其目的就是让吸附膜上残留的盐分等污染物更充分地溶解到洗涤液中。第三轮实验中加了洗涤液Buffer WA后开盖静置,可以使核酸吸附膜的上下的气压保持平衡,洗涤液在重力的作用下会缓慢渗透过吸附膜(如果仔细观察,会发现洗涤液有滴下的趋势),这样盐分等污染物就会冲洗得更彻底,所以最后OD260/OD230的比值会更高。
如果采用第三轮实验方案还觉得盐分残留高的话,就要考虑除吸附膜之外盐分残留的来源了。第四轮实验,小新在加洗涤液Buffer WA时,吸头在核酸纯化柱管口沿着管壁一圈清洗下去,然后再开盖静置5min。最后的测定数据十分完美,全都在2.0以上。

由于在靠近纯化柱管口,就是与管盖接触的周围部分是洗涤液最难清洗到的死角,所以第四轮实验在加洗涤液Buffer WA时,吸头对准核酸纯化柱管口沿着管壁一圈清洗下去,然后再开盖静置5min,则能将管壁上残留的杂质也全部带走,所以最后的测定数据也全都在2.0以上了。
看完这几个实验,我们可以把提高核酸OD260/OD230的方法归纳为两个,其一是浸泡法,其中开盖静置比闭盖静置的效果要好很多,浸泡时间在5-10分钟左右。其二是冲洗法,冲洗易被忽略的死角,将污染物去除的更彻底。两个方法都可以在一定程度上提高核酸OD260/OD230,提高核酸纯度,让下游实验无后顾之忧。
新景实验室