荧光PCR法检测RNasin性能效果
实验目的:对RNasin性能效果进行检测及评估。
实验材料及设备
模板RNA:大鼠肌肉组织RNA
引物:Rat β-acting:Forward CCCATCTATGAGGGTTACGC
Reverse TTTAATGTCACGCACGATTTC
RNase:50mg/ml(simgen)
RNasin:40U/μl
cDNA第一链合成试剂盒(simgen)、2×SYBR Green PCR mix(simgen)
设备:ABI 7000 荧光PCR仪、普通PCR仪、离心机及移液器
其他耗材:0.6ml离心管,八连排管,RNase-free吸头,一次性手套及防护用品和纸巾。
实验方法:利用逆转录反应将RNA逆转录成cDNA及SYBR Green荧光PCR方法对RNasin产品的性能效果进行检测评估。
实验方案:
编号 | RNA量 | RNase 量 | RNasin量 |
1 | 2μg | 4ng | 0 |
2 | 2μg | 40ng | 80U |
3 | 2μg | 4ng | 80U |
4 | 2μg | 0ng | 0 |
设计思路:
1. 编号1-4为测试同一批RNasin的性能,1号与3号是测试相同RNA量和RNase量,加不加RNasin对cDNA合成的影响,即RNasin抑制RNase的活性效果。
2. 4号是表示在不添加RNase和RNasin时的空白对照。
3. 2号与3号是测试在相同RNA量和RNasin量的条件下,改变RNase的量,RNasin对不同量的RNase的抑制效果有什么变化。
实验步骤:
1.将模板RNA在冰上解冻;5×gDNA Buffer、RNasin、RNA(500ng/ul)、RNase、RNA-FreeH2O、5×RT Buffer、RT-Enzymemix、RT-Primer mix 、2×SYBR Green PCR Mix、引物、在室温(15-25℃)解冻,解冻后迅速置于冰上。使用前将每种溶液涡旋振荡混匀,简短离心以收集残留在管壁的液体。
注:RNase稀释需在抽风口或远离PCR操作室的实验室。
2. 按照表1的基因组DNA的去除体系配制混合液,彻底混匀。简短离心,并置于42℃,孵育30min,以保证RNase有充分时间去降解RNA.然后置于冰上放置。
表1 gDNA去除反应体系
试剂 编号 | 1 | 2 | 3 | 4 |
5×gDNA Buffer(μl) | 2 | 2 | 2 | 2 |
RNA(μl)*1 | 4 | 4 | 4 | 4 |
RNase(ng)*2 | 2 | 20 | 2 | — |
RNasin(μl)*3 | — | 2 | 2 | — |
RNA-Free H2O(μl) | 补足到10μl | |||
注:1.RNA的浓度是500ng/μl,RNA的浓度不能太低,且RNA需在RNase之前添加,否则可能被RNase降解完从而在荧光PCR上反映不出差异。
2.RNase的浓度分别为1ng/μl和10ng/μl,故在加入RNase时均加入2μl,保证不同的量相同体积,以减少误差,在加RNase的时候应尽量在无RNase的环境中添加,以免环境中RNase过多而导致RNA降解严重从而在荧光PCR上反映不出差异。
3. RNasin的浓度为40U/μl,添加RNasin应在加RNA之前添加。
后续cDNA合成步骤参考cDNA第一链合成试剂盒(simgen)说明书操作。所得cDNA稀释5倍,置于冰上备用。
荧光PCR步骤参考2×SYBR Green PCR Mix(simgen)说明书操作。
将稀释好的cDNA模板按照5μl/管加入到荧光PCR反应体系混合液中,进行荧光PCR扩增,观察实验结果。
实验结果:
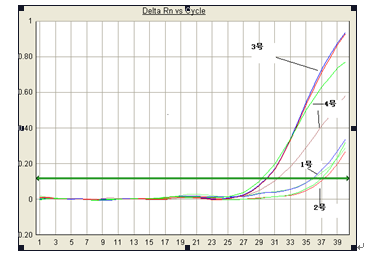
从上图看,在加2ng RNase时,加不加RNasin对cDNA的合成是有明显影响的,即3号比1号的CT值要小6个CT,表示它们的起始cDNA浓度相差大概26倍,说明RNasin对RNase的影响是非常大的。
从2号与3号对比,说明在相同量的RNasin下,当RNase的量增加到20ng时,80U RNasin的效果还不足将RNase完全抑制,说明一定量的RNasin只能对一定量的RNase有足够的抑制作用。
操作人:昌青青、徐文彪
日 期:2015-10-09

·快速、准确·兼容性强·操作简便·高效率、高灵敏度及高特异性。 查看产品

本试剂盒含有全新高效的gDNase,3min高效去除gDNA,让基因组DNA在反转前高效去除;高效Quant逆转录酶,仅需15 min即可合成满足荧光定量实验的第一链cDNA,反转效率可高达90%。 查看产品